PKseqパネルとロングリードシークエンシングを用いたCYP2D6の新規ハプロタイプの同定とその機能解析
PKseqパネルとロングリードシークエンシングを用いたCYP2D6の新規ハプロタイプの同定とその機能解析
福永 航也
理化学研究所 生命医科学研究センター ファーマコゲノミクス研究チーム
Determination of novel CYP2D6 haplotype using the targeted sequencing followed by the long-read sequencing and the functional characterization in the Japanese population
Koya Fukunaga, Eiji Hishinuma, Masahiro Hiratsuka, Ken Kato, Takuji Okusaka, Takeo Saito, Masashi Ikeda, Teruhiko Yoshida, Hitoshi Zembutsu, Nakao Iwata, Taisei Mushiroda
J Hum Genet. 2021;66:139-149.
論文のハイライト
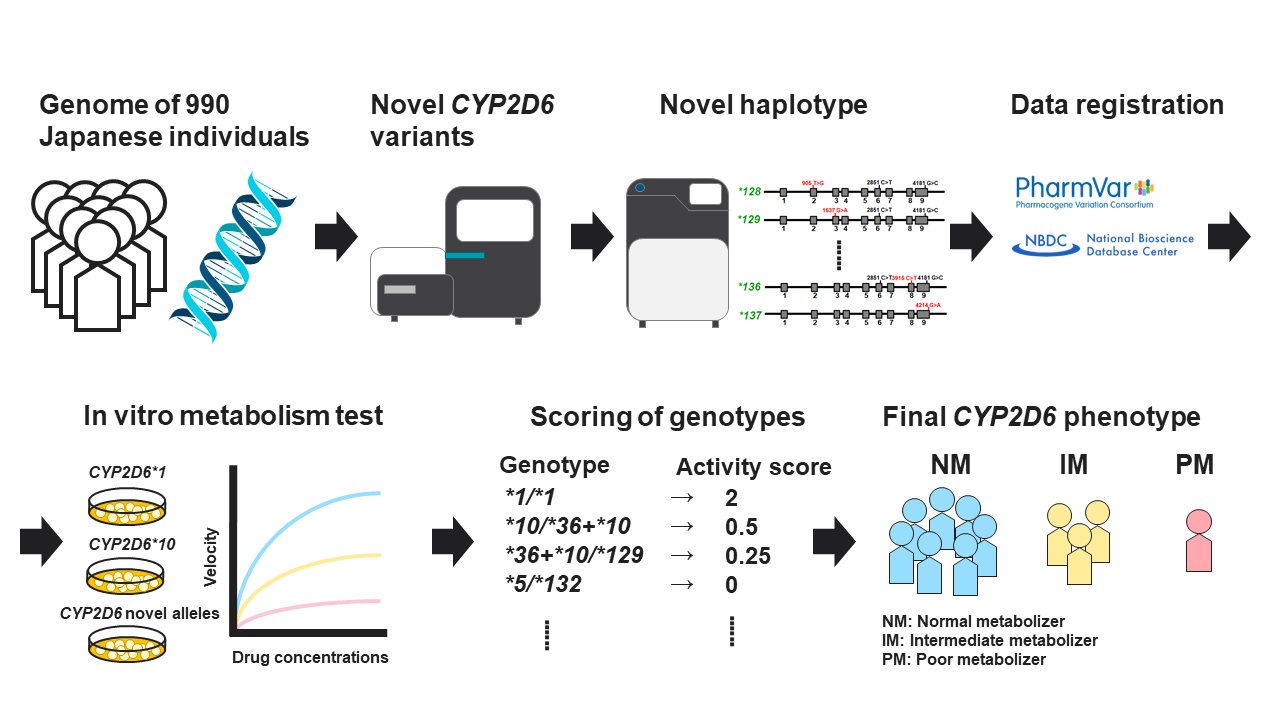
CYP2D6はチトクロームP450ファミリーに属する薬物代謝酵素であり、抗がん剤や麻薬性鎮痛薬などの代謝に関与する。この遺伝子には薬剤の効果や有害事象の発現リスクに関連するバリエーションが多数報告されている。また、生殖細胞系列のバイオマーカーの中でも社会実装が最も進んでいる遺伝子の一つである。現在のように次世代シークエンサー (NGS) が普及する以前からCYP2D6のバリエーション研究は盛んに行われており、2022年1月現在149種類のアレルがPharmacogene Variation Consortium (PharmVar, https://www.pharmvar.org/) に登録されている。一方、NGSによる大規模なシークエンシングの一般化により、CYP2D6の新規バリエーションはいまだに報告され続けている。CYP2D6には酵素活性を欠失させる*4アレルのようなバリアントや*36アレルのように偽遺伝子化しているコピー数多様性 (CNV) が高頻度で存在していることが問題になる。新規バリアントが同定されたとしても、すでに酵素活性が欠失している*4や*36などのサブアレルである場合、臨床的意義は乏しい。そのため、新規バリエーションと既知のバリエーションの間のハプロタイプ構造を決定しなければ酵素活性を正しく推定することができない。そこで、本論文では新規バリアントのハプロタイプ構造をロングリードシークエンサーによって同定し、真のCYP2D6ジェノタイプを明らかにした。また、この新規アレルの酵素活性をin vitro代謝試験で測定し、個々のジェノタイプの酵素活性を推定した。
はじめに、我々が以前に開発したPKseqパネル(Fukunaga K et al, Drug Metab Pharmacokinet. 2021. 37:100370)を用いて、日本国内で収集された990人のゲノムにおける薬物動態関連100遺伝子の翻訳領域のターゲットシークエンシングを行った。その結果、CYP2D6にアミノ酸置換を示す14箇所の新規バリアントを同定した。その後ロングリードシークエンサーを用いて14箇所の新規バリアントを含んだ全てのバリアントのハプロタイプを決定した。14箇所の新規バリアントのうち1箇所は*4に、また、2箇所は*36上に存在していた。2箇所の新規バリアントが1つのアレル上に同時に存在している新規アレルである*130も同定した。また、酵素活性を減少させるコモンアレルである*10上に存在する*132などを同定し、最終的に14箇所の新規バリアントに基づいて、CYP2D6の酵素活性に影響を与える可能性のある10種類の新規アレルを同定した。野生型と同じアレル上に新規バリアントが認められた割合は40%にすぎなかった。これらをPharmVarデータベースに*128から*137として登録した。これらの10種類のアレルの酵素活性を推定するために各アレルをHEK293細胞に一過性に発現し、それぞれのタンパク質を回収した。このタンパク質の発現量とP450量を測定した。各アレル由来のタンパク質を用いて、CYP2D6の典型的な基質であるデキストロメトルファンとN-デスメチルタモキシフェンの代謝試験を行った。固有クリアランスの値を基に*128、*129、*130および*132は活性消失型のアレルであり、*131、*133、*135および*136は活性減少型のアレルであることを明らかにした。これらのアレルを含む17人のCYP2D6ジェノタイプを決定し、in vitro酵素活性に基づいてnormal metabolizer (NM)、intermediate metabolizer (IM) およびpoor metabolizers (PM) に分類した。本研究で同定された新規アレルの情報を加えることによって、従来の分類ではNMであった6人がIMに、IMであった1人がPMに修正された。本研究の結果からNGSで得られた情報に基づいて、CYP2D6で代謝される薬物に対する全身曝露量を推定することが可能になり、薬剤の効果や有害事象の発現リスクの個人差を予測するための有益な情報を得ることができる。
工夫した点、楽しかった点、苦労した点など
本研究では、ロングリードシークエンサーを用いてCYP2D6の新規アレルを同定した点以外は、1つ1つの手法は過去に構築されたオーソドックスなものばかりです。NGSのシークエンシングでは、ショートリードとロングリードのデータをソリッドな方法で解析したり、CYP2D6アレルのタンパク質を強制発現させる細胞実験やLC-MSを用いた代謝試験を行い、機械学習によってデータをカテゴライズしたり、dryとwetの両方を右往左往する毎日でした。その中でも、in vitroの薬物代謝試験をご専門とされる東北大学大学院薬学研究科の平塚真弘先生のラボにお伺いし、菱沼英史先生にP450量の測定法をご教授いただけたことは非常に幸運でした。細部まで行き届いた研究手法を惜しみなくご教授いただき非常に感謝致しております。このように、dryとwetのそれぞれの専門家から見れば個々の作業はオーソドックスであるかもしれませんが、両方を自身で取り組んだことによって、多種多様な研究文化に触れることができ、発想を豊かにすることができたように思います。
研究室紹介
理化学研究所の生命医科学研究センターのファーマコゲノミクス研究チームでは莚田泰誠チームリーダーのもと、薬効や有害事象に関連するバリエーションを突き止め、遺伝型に基づいた薬物治療を確立することを目的としています。現在では、ファーマコゲノミクス (PGx) バイオマーカーを効率的に探索するための薬物動態関連遺伝子やヒト白血球抗原 (HLA) のターゲットシークエンシング法の開発に加え、それらを社会実装するための仕事にも取り組んでいます。また、精神・神経疾患治療薬やがん治療薬におけるPGx研究など、多様な研究プロジェクトや共同研究が進行しています。

(2022年2月撮影。右が莚田泰誠チームリーダー、左が筆者。)
