ITPR1は神経堤細胞に由来する前眼部組織形成を制御する
ITPR1は神経堤細胞に由来する前眼部組織形成を制御する
木下 晃
長崎大学原爆後障害医療研究所 人類遺伝学教室
Itpr1 regulates the formation of anterior eye segment tissues derived from neural crest cells
Akira Kinoshita, Kaname Ohyama, Susumu Tanimura, Katsuya Matsuda, Tatsuya Kishino, Yutaka Negishi, Naoko Asahina, Hideaki Shiraishi, Kana Hosoki, Kiyotaka Tomiwa, Naoko Ishihara, Hiroyuki Mishima, Ryoichi Mori, Masahiro Nakashima, Shinji Saitoh, Koh-Ichiro Yoshiura.
Development. 2021;148:dev188755.
論文のハイライト
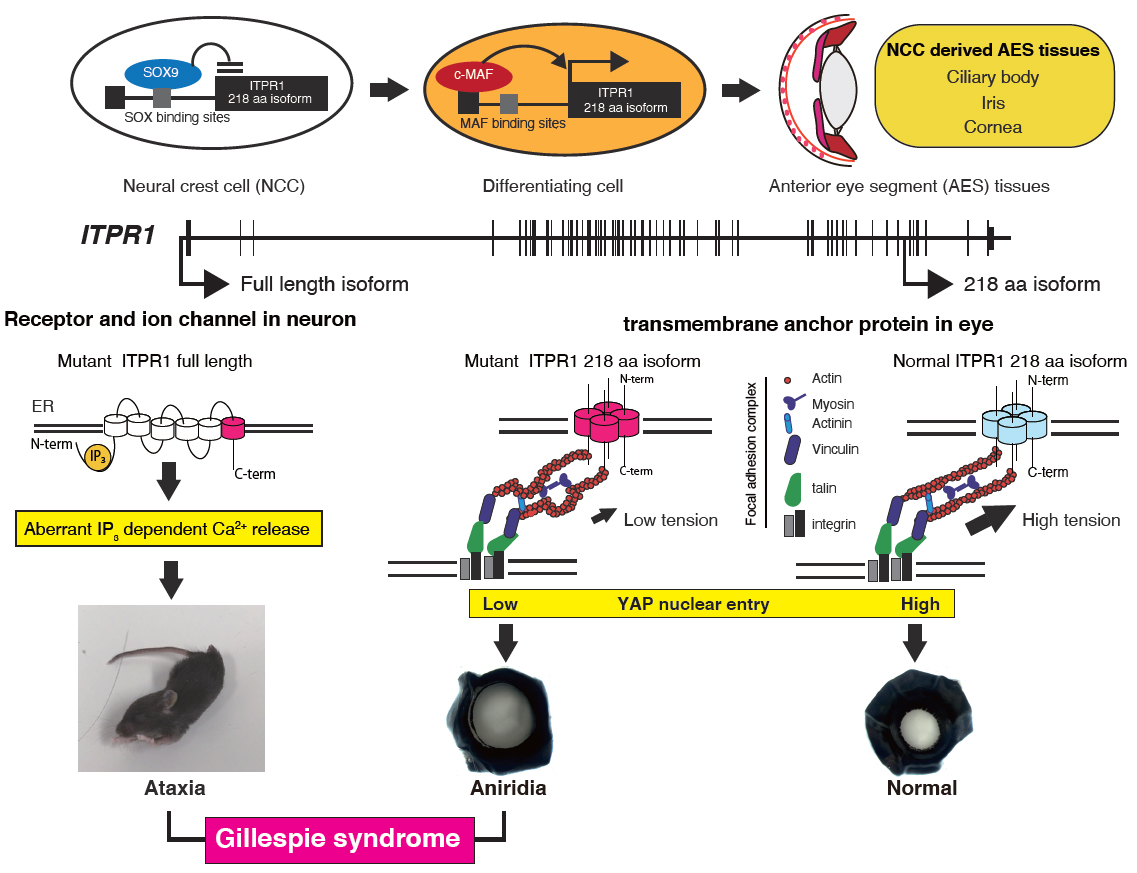
小脳失調と無虹彩を特徴とする稀な遺伝疾患Gillespie syndrome (GLSP)患者5名においてinositol 1,4,5-triphosphate receptor type I (ITPR1)のC-末端側にde novo変異のホットスポットを同定した。ITPR1は61個のエキソン(マウスでは62個)と2,743アミノ酸からなる巨大なカルシウムチャンネルである。ITPR1は脊髄小脳変性症の責任遺伝子として知られているが「なぜGLSP患者のみで無虹彩が発症するのか?」は謎であった。この謎を解明するために、まずItpr1のC-末端にV5-tagをノックインしたマウス (Itpr1V5) を作製した。このマウスとV5抗体を用いた免疫染色により、神経堤細胞 (NCC) に由来する虹彩ストロマ、角膜の内皮およびストロマにItpr1が局在することを明らかにした。
次に変異ホットスポットの上流に「未知の眼特異的な転写開始点 (TSS) 」が存在すると仮定し、Itpr1V5/V5マウスの脳と眼から抽出したRNAをV5配列特異的プライマーで逆転写しRNA-seqを行なった。その結果、マウスのエキソン57の上流GRCm38/mm10 chr6:108,517,585 (ヒトエキソン56の上流、GRCh37/hg19 chr3:4,854,885に相当)が眼特異的新規TSSであることを明らかにした。このTSSの上流領域は強い転写活性を持ち、眼の発生に関わる転写因子c-MAFにより活性が更に増強された。またNCCマーカー転写因子SOX9により転写活性は抑制された。このTSSからの転写産物は、膜貫通ドメインを1つ持つ218アミノ酸残基のタンパク質 (218 aaアイソフォーム) をコードする。眼特異的にこのアイソフォームに由来するバンド (25 kDa) がイムノブロッティングで確認され、眼の発生に伴いその発現量は増加した。
ヒトと異なりマウスでは生後3週間で眼の構造が完成する。これまでに作製されたItpr1ノックアウトマウスは生後すぐに死亡するため、眼の発生過程を観察できない。そこで我々はItpr1の終止コドンの直前に7 bpの欠失を持つマウスを新たに作製した (Itpr1Δ7bp)。Itpr1Δ7bp/Δ7bpマウスは生後3週まで生存可能で、小脳失調に加えてNCC由来の前眼部組織形成が阻害された無虹彩の表現型が再現された。
最後に218 aaアイソフォームが、NCCから前眼部組織への分化を制御する機構を明らかにするために次の実験を行った。質量分析の結果、Itpr1に結合するタンパク質はアクチン・ミオシン・アクトマイシンなどfocal adhesion (FA) に関係するものであった。そこでドキシサイクリン存在下で野生型または変異型の218 aaアイソフォームを発現するマウス線維芽細胞 (NIH3T3) 株を樹立し、アクチン線維とFAを蛍光免疫染色で観察した。野生型は太く一定の方向性を持つアクチン線維とFAが観察されたのに対して、変異型では細く方向性がバラバラになっていた。更に野生型はmechanosensitive transcriptional regulatorであるYes-associated protein (YAP) の核内移行を促進するが、変異型では促進されなかった。218 aaアイソフォームが生み出す張力がYAPのような転写関連因子の核内移行を促進し、NCCから前眼部組織への分化を制御する。その破綻がGLSP患者における無虹彩の原因であると結論づけた。
ITPR1のC-末端の36アミノ酸配列は魚からヒトにいたる脊椎動物では保存されているが、複眼をもつショウジョウバエや眼を持たない線虫、ファミリーメンバーであるITPR2および3では保存されていない。ITPR1のC-末端にはこれまでに知られていない機能があると考えられる。
工夫した点、楽しかった点、苦労した点など
眼の発生は高校の教科書レベルのことしか知らず、手探りで無虹彩の発症機序を明らかにしました。変異の同定時には直ぐに結果が出るだろうと高を括っていましたが、実際には一歩前進一歩後退を繰り返しながら、死屍累々のデータを日々産み出し、Development誌に掲載されるまでに約10年の月日を要しました。あまりに時間がかかりすぎたので、何を苦労したのかも忘れてしまいましたが、変異を同定した齋藤伸二・名古屋市立大学教授をあまりにもお待たせしたのが心苦しかったです。
ラッキーだったのはItpr1Δ7bpマウスの誕生です。CRISPR/Cas9システムでV5-tagとEGFPの融合遺伝子をC-末端にノックインしたマウスを作製する予定だったのですが、目的のマウスは作製できず、たまたま生まれたマウスです。表現型が何も出ないので処分しようかとも思いましたが、駄目元で交配させ、GLSPの表現型が再現された時にはCamurati-Engelmann病の変異を同定したときと同じくらい興奮しました。
研究室紹介
本研究室は吉浦孝一郎教授の下、単一遺伝病の責任遺伝子の同定を中心に研究を行っており、筆者はモデルマウスや培養細胞を用いた分子生物学的アプローチで発症機序の解明に取り組んでいます。大学院生も少なく寂しい現状ですが、先代の新川詔夫教授の時代から日本人類遺伝学会の学会賞・奨励賞の受賞者、各大学の教授、Nature、Science、Nature Geneticsの筆頭著者などを輩出してきた伝統ある研究室です。

(写真は2019年の人類遺伝学会に合わせて開催した同門会で撮影)
