NOTCH2NLCリピート超伸長を有する非発症父由来のリピート伸長で発症した”孤発性”神経核内封入体病症例の発症機序への考察:ジェネティック・エピジェネティックプロファイリング
NOTCH2NLCリピート超伸長を有する非発症父由来のリピート伸長で発症した”孤発性”神経核内封入体病症例の発症機序への考察:ジェネティック・エピジェネティックプロファイリング
福田裕美
横浜市立大学大学院医学研究科 遺伝学教室
Father-to-offspring transmission of extremely long NOTCH2NLC repeat expansions with contractions: genetic and epigenetic profiling with long-read sequencing.
Hiromi Fukuda, Daisuke Yamaguchi, Kristofor Nyquist, Yasushi Yabuki, Satoko Miyatake, Yuri Uchiyama, Kohei Hamanaka, Ken Saida, Eriko Koshimizu, Naomi Tsuchida, Atsushi Fujita, Satomi Mitsuhashi, Kazuyuki Ohbo, Yuki Satake, Jun Sone, Hiroshi Doi, Keisuke Morihara, Tomoko Okamoto, Yuji Takahashi, Aaron M. Wenger, Norifumi Shioda, Fumiaki Tanaka, Naomichi Matsumoto and Takeshi Mizuguchi.
Clin Epigenetics. 2021;13:204.
論文のハイライト
神経核内封入体病(neuronal intranuclear inclusion disease; NIID)は認知症や筋力低下など様々な症状を引き起こす進行性の神経変性疾患で、2019年にNOTCH2NLC遺伝子の5’UTR上にあるGGCリピート配列の伸長が原因であると同定された。NIIDでは孤発例、家族例いずれも報告されており、どちらもNOTCH2NLC遺伝子のGGCリピート伸長が原因であることが明らかとなっている。当教室ではRepeat primed PCR (RP-PCR)とAmplicon length analysis (AL-analysis)によるトリオ解析により、de novoのリピート伸長変異が疑われる4人の孤発性NIID患者を同定したが、そのGGCリピート伸長の起源や機序については不明であった。そこで、孤発性NIID患者とその両親の検体が得られた4家系に対して、詳細なリピート数・配列を調査しde novo発症の機序を明らかにしたいと考えた。
GGCのリピート伸長は100% GCリッチで通常のDNA解析では全く歯が立たず、ロングリードシーケンサーのみが唯一の解読法である。そこで両親に臨床症状がなく、孤発性NIIDと考えられた4人の患者家系についてOxford NanoporeとPacBio Sequel IIを使用したロングリードシーケンス解析を行った。共にCRISPR/Cas9によりNOTCH2NLCのGGCリピートを含む配列を切り出し濃縮することで高カバレッジを実現することで、詳細な塩基配列レベルの解析が可能となった。
NIIDは孤発例が多いことが知られていることから、当初は孤発性NIID患者のGGCリピートや周辺の配列にリピート伸長傾向をもたらす配列が含まれるのではないかとの仮説を立て、当教室で開発したtandem-genotypesというプログラムを用いて、まずリピートコピー数解析を行った。ところが、実際には全家系で無症候父が患者よりも極めて長いリピート伸長配列を持つことが判明した。
さらにPacBioのHiFiリードから実際のコンセンサス配列を作成し、伸長変異配列の比較を行った。患者はリピートサイズが縮小していたものの父とリピート伸長配列の非典型パタンの構成が同じであったことから病原性に関わるリピート伸長アレルは父方起源であることが示唆された。この結果はAL-PCRにより正常アレルが母方起源であることからも支持された。
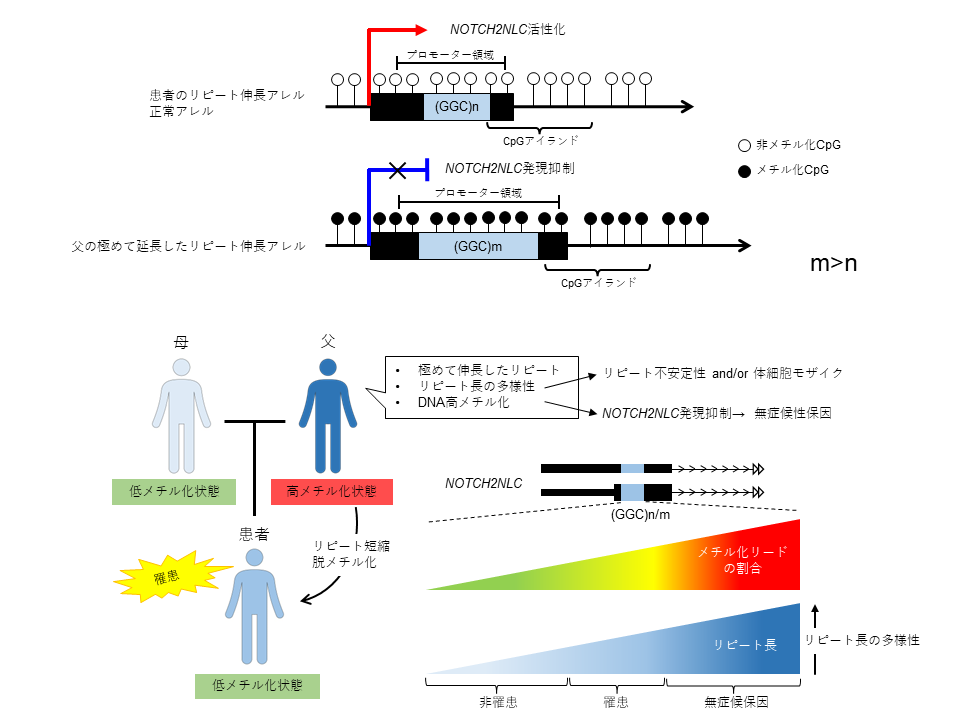
保因者の父に臨床症状がないことは、患者と父との間でGGCリピート伸長の機能的結果に違いがあることが示唆される。そこで患者よりも長いリピート伸長配列を有するにも関わらず無症候性保因者である父のゲノムDNAメチル化状態を調査することとした。
まずはPacBio単一分子リアルタイム(SMRT)シーケンス実行中におけるpolymerase kineticsの測定から推測できる塩基修飾を調べた。無症候父のリピート伸長アレルではリピート領域でDNA ポリメラーゼ速度の遅延を認めたことから、何らかの塩基修飾の存在を確認した。そこでメチル化サザンブロット解析を行ったところ、父でのみNOTCH2NLC領域の高メチル化CpGが確認された。
高メチル化領域をより高解像度に調べるためにNanoporeシークエンスデータから5-mCを検出するカスタムプログラムを開発した。この分析はベースコールプログラムであるGuppyに基づき塩基修飾確率を計算することで5-mCを直接識別する。Guppyからの塩基修飾情報はカスタムプログラムであるmethylstatによりゲノム位置に割り当てられ、methylcallを使用してそのゲノム位置でのメチル化コールに使用した。患者と父でメチル化コールを比較すると、父のリピート伸長アレルでのみGGCリピート伸長の700bp上流と1000bp下流を含むゲノム領域が過剰に高メチル化されていることが示された。
最近の研究でNOTCH2NLC伸長配列由来の転写産物からリピート含有RNA fociが生成されたり、有毒なポリグリシン含有タンパク質(poly G)に翻訳されることが示された。無症候性保因者の父では高メチル化によるエピジェネティックな転写抑制を通じて、有毒なpoly Gやリピート含有RNA fociの発現が抑制されるかどうかを調べた。免疫染色法とRNA FISH法により、ユビキチンとp62の両方が陽性に染色される核内封入体がGGCリピートの転写産物を表すGGC-RNAと共局在することが罹患症例でのみ確認された。このことから、極めて長いリピート伸長配列を持つ無症候性保因者の父は臨床的にも病理学的にも正常であることが示された。さらに、RT-qPCRで無症候父のmRNAのレベルが患者や健常母に比べて優位に低下していたこと、GGC RNA FISHの核シグナル強度が比較的低下していたことからも無症候性保因者の父におけるNOTCH2NLCの転写抑制の可能性が示唆された。
以上のことから、父親の極めて長いGGCリピート伸長はエピジェネティックな変化によってNOTCH2NLCサイレンシングを引き起こす可能性が考えられた。
工夫した点、楽しかった点、苦労した点など
大学院に入って間もない頃にこの研究テーマを与えられましたが、開始当初NIIDの疾患原因遺伝子が判明したばかりであったこともあり、何もかもが手探りの状態でした。与えられたNIID家系の遺伝的機序を探るために様々な実験を行い失敗を重ねてまいりましたが、研究指導して頂いた水口剛准教授をはじめとする先生方やインフォマティクス関係者の手厚いサポートをいただき、徐々に方向性が定まり研究を進めることができました。また、メチル化の解析中に類似の結果を示す論文が他研究所から先に示され最前線の研究スピードに圧倒されましたが、二つのロングリードシーケンス技術を組み合わせることで差別化を図り論文化に至りました。大学院という立場ながら最新の研究に携わるという恵まれた環境を与えてくださったことに感謝しております。
研究室紹介
横浜市立大学遺伝学教室は松本直通教授の下、希少疾患のゲノム解析と新規疾患概念の確立を主なテーマに据えて、様々なゲノム解析技術開発とその応用をしています。ショートリード・シーケンサーによる解析を中心に未解明症例の原因究明を行っていますが、近年ではロングリードシーケンサーを用いた解析手法を駆使することで、以前は解析が難しかった構造変異やリピート領域などの解析にも取り組んでいます。ご興味のある方は研究室ホームページ(https://www-user.yokohama-cu.ac.jp/~genetics/)をご覧ください。
