神経学的退行と関連する亜致死性のATP11A変異は、細胞膜でのホスファチジルコリンの異常な反転を起こす
神経学的退行と関連する亜致死性のATP11A変異は、細胞膜でのホスファチジルコリンの異常な反転を起こす
菊池敦生
東北大学病院 小児科
A sublethal ATP11A mutation associated with neurological deterioration causes aberrant phosphatidylcholine flipping in plasma membranes
Katsumori Segawa*, Atsuo Kikuchi*, Tomoyasu Noji, Yuki Sugiura, Keita Hiraga, Chigure Suzuki, Kazuhiro Haginoya, Yasuko Kobayashi, Mitsuhiro Matsunaga, Yuki Ochiai, Kyoko Yamada, Takuo Nishimura, Shinya Iwasawa, Wataru Shoji, Fuminori Sugihara, Kohei Nishino, Hidetaka Kosako, Masahito Ikawa, Yasuo Uchiyama, Makoto Suematsu, Hiroshi Ishikita, Shigeo Kure, Shigekazu Nagata†
J Clin Invest, 2021;131:e148005.
論文のハイライト
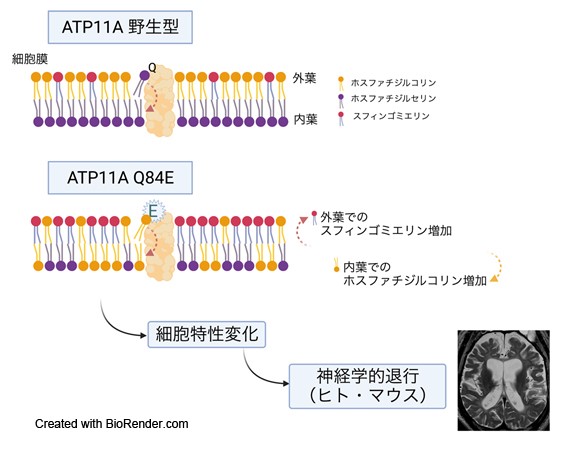
哺乳類の細胞における細胞膜の脂質二重層は、その外葉と内葉でリン脂質の組成が異なっている。この非対称性分布の維持には、フリッパーゼと呼ばれる分子がATPを使って特定のリン脂質を外葉から内葉へ輸送していることが関与している。いくつかのフリッパーゼの機能異常はヒト疾患との関連が報告されている。例えば、ATP8A2の両アレル性バリアントが小脳失調やてんかん性脳症の原因として知られているほか、ATP11Cのバリアントによる先天性溶血性貧血の報告もある。ATP11Aもフリッパーゼの1種であり、リン脂質のうち主にホスファチジルセリン(PS)を基質にとる分子である。しかし、この分子の機能異常によるヒト疾患はこれまで報告がなかった。
筆者らは大脳萎縮・髄鞘低形成、幼児期からの神経学的退行を伴う患者を経験した。既存の疾患概念には当てはまらず20年以上にわたり未診断であったため、トリオエクソーム解析を行った。その結果、ATP11A遺伝子にde novoヘテロ接合性ミスセンスバリアント(NM_015205.3:c.250C>G, p.Gln84Glu)を同定した。健常人データベースに登録のないまれなミスセンスバリアントで、このアミノ酸残基の周囲は種間で高度に保存されていた。興味深いことに、ATP11Aの第1膜貫通領域に相当するこの領域のアミノ酸残基は、ある種のホモログにおいてフリッパーゼの基質特異性を規定していることが示唆されていた。そこで実際にヒト野生型/変異型ATP11Aの安定発現細胞株を解析すると、変異型ATP11Aは本来の基質であるPSだけでなく、ホスファチジルコリン(PC)をも輸送する能力があり、このバリアントは機能獲得性変異であることが判明した。分子動力学シミュレーションにより、この変異による構造変化は新たにPCをATP11A分子のリン脂質導入部位に結合させることが示された。PCを基質にとる機能を獲得したこの変異型ATP11A発現細胞では、細胞外葉のPCが減少し、別のリン脂質であるスフィンゴミエリンが増加していた。細胞膜内外のリン脂質の組成変化に加えて、変異型ATP11A発現細胞では細胞増殖能が低下し、細胞サイズが小型するなど、細胞特性にも変化が生じていた。細胞レベルの解析と合致して、変異型ノックインマウスの胎児脳ではスフィンゴミエリンの蓄積を認め、生後数週間で神経変性症状を呈した。
以上より筆者らはフリッパーゼATP11Aの基質特異性は細胞膜内外のリン脂質の適切な分布に重要であり、その破綻は神経疾患を生じうることを明らかにした。
工夫した点、楽しかった点、苦労した点など
ホモログの知見から、同定したバリアントは基質特異性を変化させて疾患を起こしているのではないか、という仮説を立てたものの、このままでは完全な妄想です。この分子の専門家による機能解析が必要でした。病的意義を支持する予備的実験データのみを携えて上司の呉繁夫教授と猛暑の大阪に乗り込み、大阪大学長田重一先生の研究室でプレゼンテーションしたときの緊張を今でも覚えています。結局、教室の瀬川勝盛先生(現:東京医科歯科大学)を中心に解析を引き受けてもらえることになり、機能獲得性変異の最初のデータが示されたのはそのわずか1-2か月後でした。当初の妄想に付き合って、その後4年近くにわたる機能解析の大部分を担当された瀬川先生に感謝です。
希少疾患のゲノム解析では有力な候補バリアントを同定しても、同一のバリアントをもつ別の家系が見つからない、いわゆるn-of-1問題に悩まされた方もおられるかと思います。今回の症例でも国内外のデータシェアリングによっても2例目が同定されずヒトでの遺伝学的証明とはなりませんでしたが、徹底した機能解析のおかげで論文出版に至りました。とっておきの候補であれば、あきらめずに検証に進んでみてもよいかもしれません。
研究室紹介
東北大学小児科実験室では主に呉繁夫教授のもとに、希少疾患のゲノム解析と新規疾患概念の確立を主なテーマとして取り組んでおります(2021年12月現在)。比較的身近な患者さんの分子診断から新しい発見を求め、日々バリアントの海を泳いでおります。

2017年春の集合写真。後列右端が呉教授、後列左端が筆者。
